Covid-19-vaccination
På denne side kan du finde information om de vacciner, der aktuelt anvendes i vaccinationsprogrammerne mod covid-19. Informationen henvender sig primært til sundhedspersoner.
Den 1. oktober 2023 starter efterårets vaccinationsindsats med covid-19-booster-vaccination. De målgrupper der indgår i tilbuddet om gratis covid-vaccination er i år sammenfaldende med målgrupperne for gratis influenzavaccination. (Dog tilbydes børn i alderen 2-6 år også gratis vaccination mod influenza).
Booster-vaccination (eller evt. primærvaccination) vil ske med den variantopdaterede covid-19-vaccine Cominarty omicron XBB.1.5.
Information til borgere om covid-19-vaccination findes på Sundhedsstyrelsens hjemmeside: Covid-19 - Sundhedsstyrelsen.
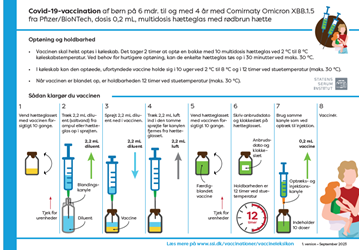
Infografikker med vejledning om opbevaring, holdbarhed og klargøring for Comirnaty Omicron XBB.1.5
Personer over 12 år (grå hætte)
Børn fra 5 til 11 år (blå hætte)